1) L'atome :
Toute matière est donc constituée de molécules. Mais que sont ces
molécules ? Commençons par le commencement : les plus petites parties de la matière sont les atomes.
Comment les définir ? A titre d'exemple, on trouve dans un litre d'eau environ
3.1025 atomes d'oxygène et 6.1025 atomes d'hydrogène.
Remarque : 3.1025 se dit "3 fois 10 puissance 25". Cela équivaut à 30 millions de milliards de milliards d'atomes ! Ainsi, on peut écrire le nombre 100 de plusieurs manières : 1.102 (qu'on écrit 102 tout court puisque le point équivaut à multiplier) ou 10.101 ou encore 0,1.103 mais aussi 1000.10-1 ou 100000.10-3... Autrement dit, la puissance correspond à la position de la virgule par rapport au chiffre indiqué avant le point. Cette notation est pratique pour les grands nombres.
En fait, on peut assimiler un atome à une sphère dont le diamètre est de l'ordre du dixième de nanomètre (1 nm = 1.10-9 m) et sa masse approche les 10-26 kg.

Dans tout atome, il y a des électrons (en rouge) qui gravitent autour d'un noyau central (en vert et blanc). Un électron est une particule élémentaire de masse négligeable et portant une charge électrique négative de -1.
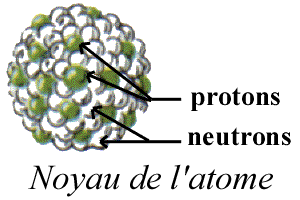
Le noyau est constitué de deux autres particules élémentaires : le proton (en vert), de charge électrique positive +1, et le neutron (en blanc), qui est par définition électriquement neutre. Le nombre d'électrons gravitant autour du noyau est toujours égal au nombre de protons dans le noyau, autrement dit un atome est toujours électriquement neutre. En revanche, le nombre de neutrons est variable.
La masse d'un atome A est ainsi à peu près égale au nombre de protons Z ajouté au nombre de neutrons N : A = Z + N.
Remarque1 : un atome peut perdre ou gagner un électron lors d'une réaction chimique. On le qualifie alors d'ion. Un atome qui a gagné un ou plusieurs électrons est un anion (il est chargé négativement), un atome qui a perdu un ou plusieurs électrons est un cation (il est chargé positivement).
Remarque 2 : les électrons des atomes sont en réalité répartis en plusieurs couches autour du noyau. La couche la plus proche (de rang 1) est notée K, la couche de rang 2 est notée L... Le nombre d'électrons par couche est limité à 2n², autrement dit la couche K contient [2 x (1x1)] = 2 électrons au maximum.
La représentation sphérique d'un atome vient du fait que son noyau l'est effectivement et que les électrons, par leur trajectoire, renforce également cette forme.
2) La classification des atomes
:
Il existe dans la nature un certain nombre d'atomes différents. Ils ont été
classés par le russe Mendeleiev dans un tableau dit "Tableau de la
classification périodique des éléments". Un élément est ce qui est commun à un
corps simple et à tout ses composés (exemple : le cuivre est l'élément commun au
cuivre métallique, au nitrate de cuivre et à l'oxyde de cuivre). Cette
classification est basée sur de multiples critères, le plus simple étant le
numéro atomique Z (nombre de protons dans l'atome). Chaque atome a un symbole
qui est noté dans le tableau. Soit un atome de symbole X : on note
AZX.
Exemple :
l'oxygène O avec Z = 8 et A = 16 :
l'atome d'oxygène possède 8 protons et donc 8 électrons qui gravitent autour du
noyau qui possède en plus de ces 8 protons (16 - 8) = 8 neutrons.
L'uranium U avec Z = 92 et A = 238.03 : l'atome d'uranium a 92 protons, 92
électrons et (238.03 - 92) = 146.03 soit 146.
Voir la classification périodique des éléments (tableau)
Ce tableau comprend 18 colonnes et 7 lignes (ou périodes). Les éléments sont donc classés par ordre croissant de leur numéro atomique. La première période contient deux éléments, l'hydrogène et l'hélium. Les éléments en rouge ont été obtenus par synthèse en laboratoire. Tous les autres existent dans la nature.
L'intérêt est que les atomes qui
ont le même nombre d'électrons sur leur couche externe (voir Remarque 2
de la partie 1) sont placés dans une même colonne. On dit qu'ils appartiennent à
une même famille :
- la colonne 18 correspond à la famille des "gaz rares" ou
"gaz inertes" ou encore "gaz nobles" : hélium, néon, argon, krypton, xénon et
radon. Mis à part l'hélium (deux électrons), ces gaz ont 8 électrons sur leur
couche la plus externe. Tout ces gaz rares ont une grande stabilité et ont une
réactivité chimique quasi-nulle.
- la colonne 17 est la famille des "halogènes" : fluor,
chlore, brome, iode et astate. Ils possèdent 7 électrons sur leur couche
externe. Ces éléments réagissent avec un grand nombre d'éléments car ils peuvent
arraché un électron à d'autres atomes (voir la Remarque 1 du 1). Ainsi,
les halogènes sont sous la forme d'anions avec 8 électrons sur leur couche
externe au lieu de 7. Par exemple, l'anion chlorure Cl- (on note la
charge électrique de l'ion en exposant en haut à droite) qui est présent dans le
sel.
- la colonne 1 est la famille des "métaux alcalins" (sauf
l'hydrogène) : hydrogène, lithium, sodium, potassium, rubidium, césium et
francium. Ces éléments n'ont qu'un électron sur leur couche externe : ils le
perdent facilement en présence de certains éléments, comme l'anion chlorure par
exemple. C'est à nouveau le cas dans le sel qui est fait de Na+ et Cl-.
Ce sont donc les électrons de la couche externe qui déterminent les propriétés chimiques des éléments.
3) Les molécules :
Maintenant que nous savons ce qu'est un atome,
intéressons nous aux molécules. Une molécule, c'est tout simplement un
assemblage d'au moins deux atomes.
En fait, les électrons de la couche externe d'un atome se différencient par des
règles définies par Lewis :
- certains électrons de la couche externe d'un atome ont la
propriété de se grouper par deux pour former un doublet d'électron.
- d'autres au contraire ne sont pas engagés dans un doublet;
on les appelle électrons célibataires.
La formation d'une molécule se fait par la
liaison dite covalente entre deux atomes. Cette liaison consiste à la mise en
commun de deux électrons célibataires appartenant chacun à un noyau atomique
différent pour former un doublet.
Une molécule est donc un édifice chimique
électriquement neutre formé d'atomes liés entre eux par des liaisons covalentes.
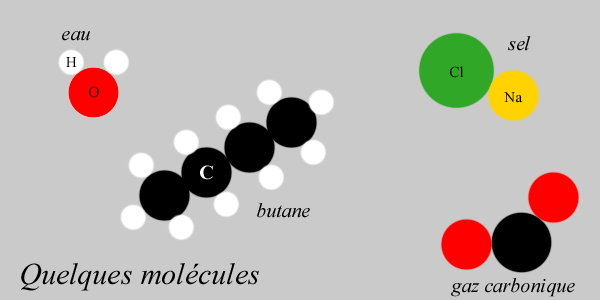
Sur ce schéma, vous pouvez voir 4 molécules : la molécule d'eau (H2O), la molécule de sel ou chlorure de sodium (NaCl), la molécule de gaz carbonique ou dioxyde de carbone (CO2) et la molécule de butane (C4H10). Les notations entre parenthèses sont appelées formules brutes des molécules, c'est-à-dire que cette formule donne la composition de la molécule en nombre d'atomes (atomicité de la molécule) sans tenir compte de la façon dont ils sont liés. Sur le schéma, il s'agit d'une représentation en deux dimensions de l'agencement des atomes entre eux. Il existe aussi une représentation dite formule développée qui consiste à représenter la molécule avec les symboles des atomes reliés entre eux par des traits pour montrer les liaisons covalentes. Cette représentation est courante et permet de montrer les angles formés par les liaisons atomiques.
4) Les groupes
atomiques :
Dans les molécules, on définit parfois des groupes d'atomes qui donne sa
nature à la molécule. Par exemple, un groupe hydroxyle (OH) lié à un atome de
carbone donne la fonction "alcool" à la molécule :
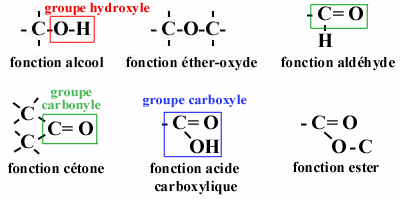
La compréhension de cette nomenclature permet de mieux comprendre par la suite les noms et classements de certaines molécules.
Il existe des molécules beaucoup plus complexes que celles présentées dans cette page. C'est le cas des molécules du vivant qui sont à découvrir...